6. Przemiany gazu doskonałego
1. Przemiana izotermiczna – przemiana gazu przy stałej temperaturze
prawo Boyle'a – Mariotte'a:
pV = const
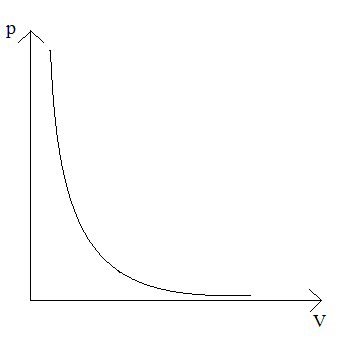
Izoterma – wykres zależności ciśnienia od objętości w przemianie izotermicznej.
Izoterma ma kształt hiperboli.
I zasada termodynamiki w przemianie izotermicznej:
ΔU = Q + W
ΔU = ½ niR·ΔT
ΔT = 0 → ΔU =0
Q = -W
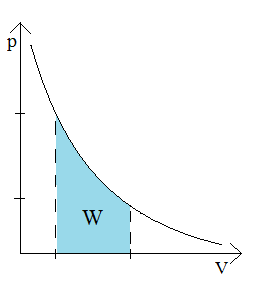
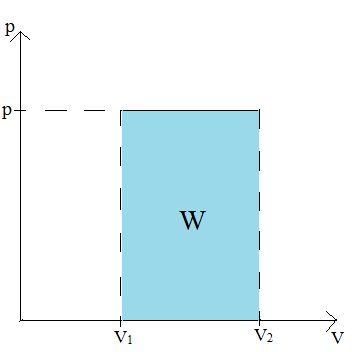
Praca w przemianie izotermicznej:
2. Przemiana izochoryczna – przemiana przy stałej objętości
prawo Charlesa:
Izochora – wykres zależności ciśnienia od temperatury w przemianie izochorycznej
I zasada termodynamiki w przemianie izochorycznej:
V = const → W = 0
ΔU = Q
Praca w przemianie izochorycznej:
Ciepło w przemianie izochorycznej:
Q = cV·m·ΔT
cV - ciepło właściwe przy stałej objętości
Q = CV·n·ΔT
n - ilość moli gazu
CV - molowe ciepło właściwe przy stałej objętości
3. Przemiana izobaryczna – przemiana przy stałym ciśnieniu
prawo Gay-Lussaca
Izobara – wykres zależności objętości od temperatury w przemianie izobarycznej
I zasada termodynamiki w przemianie izobarycznej:
ΔU = Q + W
Praca w przemianie izobarycznej:
Ciepło w przemianie izobarycznej:
Q = cp·m·ΔT
cp - ciepło właściwe przy stałym ciśnieniu
Q = Cp·n·ΔT
Cp - molowe ciepło właściwe przy stałym ciśnieniu
Cp = Cv + R
R – uniwersalna stała gazowa
4. Przemiana adiabatyczna – przemiana gazu bez wymiany ciepła z otoczeniem
prawo Poissona:
pVK = const
K – kappa
1 < K < 2
K = Cp / Cv
K = (i+2)/i (dla gazu doskonałego)
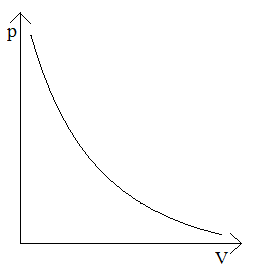
Adiabata – wykres zależności ciśnienia od objętości w przemianie adiabatycznej
Adiabata jest bardziej stroma od izotermy.
p ~ VK
Sprężanie adiabatyczne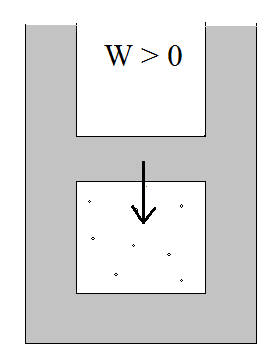
ΔU = W > 0 (praca wykonana nad gazem, aby zmniejszyć jego objętość)
ΔU > 0 → ΔT > 0
Temperatura rośnie, objętość maleje.
Rozprężanie adiabatyczne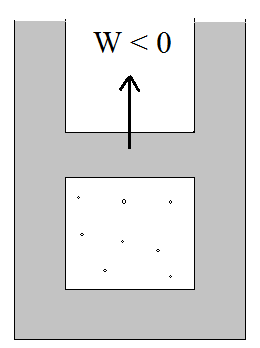
ΔU = W < 0 (praca wykonana przez gaz)
ΔU < 0 → ΔT < 0
Temperatura maleje, objętość rośnie.
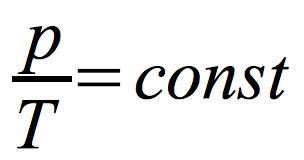
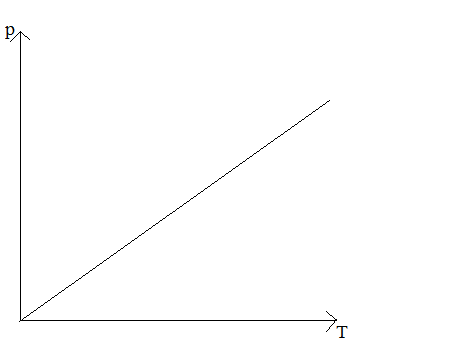
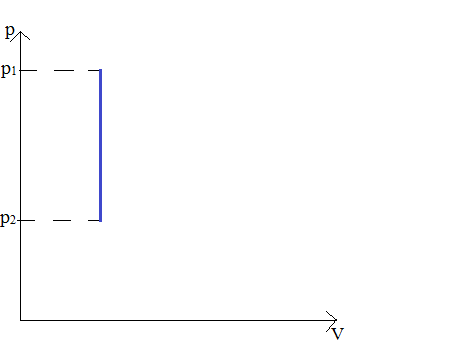
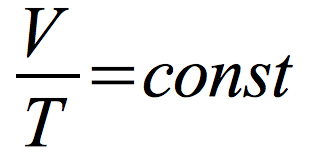

 (448 votes, average: 4,28 out of 5)
(448 votes, average: 4,28 out of 5)